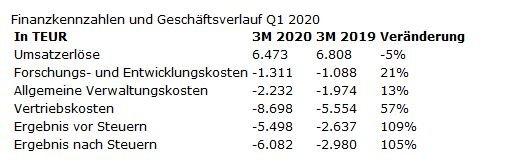
Der Umsatz des Unternehmens für den Zeitraum vom 1. Januar bis 31. März 2020 lag mit 6,5 Mio. EUR etwa 5% hinter dem Umsatz im Vorjahreszeitraum, wobei die aktuelle COVID-19-Pandemie einen großen Einfluss auf die Geschäftsentwicklung hatte. Die größten Auswirkungen waren in den USA zu verzeichnen. In unserem größten Absatzmarkt konnten wir Produktverkäufe in Höhe von 4,2 Mio. EUR verglichen mit 5,2 Mio. EUR im Vorjahreszeitraum erzielen. Dies entspricht einem Umsatzrückgang von 19% im Vergleich zum ersten Quartal 2019. Nach leicht abgeschwächten Umsätzen zu Beginn des Jahres aufgrund der Bevorratung der Ärzte mit Ameluz® im vierten Quartal 2019 im Rahmen der Preiserhöhung zum 1. Januar 2020 konnten wir ab Mitte Februar Umsätze im Rahmen unserer ursprünglichen Planungen verzeichnen. In den letzten zwei Wochen des Quartals kam das US-Geschäft allerdings aufgrund der Coronavirus-Krise nahezu komplett zum Erliegen.
Der Vertrieb in Deutschland startete stark in das neue Jahr und übertraf zunächst deutlich unsere Erwartungen. Trotz aufgrund der Corona-Krise deutlich reduzierter Umsatzzahlen am Ende des Quartals stiegen die Produktumsätze in diesem Land insgesamt im ersten Quartal 2020 um 22% auf 1,3 Mio. EUR an, verglichen mit 1,1 Mio. EUR im ersten Quartal 2019. Die im europäischen Ausland erzielten Umsätze beliefen sich auf rund 0,8 Mio. EUR, verglichen mit 0,6 Mio. EUR im gleichen Zeitraum des Vorjahres. Hauptverantworlich für diesen Anstieg waren unter anderem höhere Lieferungen an Lizenzpartner, vor allem aber die in Spanien erwirtschafteten Umsatzerlöse. Diese entwickelten sich vor den dortigen strengen Lockdown-Einschränkungen aufgrund der COVID-19-Pandemie sehr stark, was uns zuversichtlich macht in Hinblick auf eine zügige Erholung der Umsätze nach einer Aufhebung der dortigen Lockdown-Maßnahmen.
Die operativen Kosten, insbesondere die Vertriebskosten, stiegen im Vergleich zum Vorjahresquartal stark an. Ursächlich dafür waren vor allem Abschreibungen auf die XepiTM-Lizenz. Diese setzen sich zum einen zusammen aus 0,5 Mio. EUR planmäßiger Abschreibungen, zum anderen haben wir die XepiTM-Lizenz im Rahmen eines Impairment-Tests neu bewertet und aufgrund der durch die Corona-Krise erwarteten geringeren Geschäftsaussichten eine außerplanmäßige Abschreibung in Höhe von 2,0 Mio. EUR vorgenommen.
"Die ersten drei Monate diesen Jahres verliefen gemischt für uns. Mit einer zunächst guten Umsatzentwicklung, positiven regulatorischen und klinischen Entwicklungen sowie der erfolgreichen Umstrukturierung der globalen Vertriebsstruktur starteten wir sehr zuversichtlich ins Jahr 2020. Seit März 2020 dominieren die direkten Auswirkungen der COVID-19-Pandemie, rückgängige Umsatzzahlen und damit verbundene unternehmensweite Kostensenkungmaßnahmen unsere Geschäftsentwicklung", resümiert Prof. Dr. Lübbert, CEO der Biofrontera. "Im April 2020 haben wir einen Lizenzvertrag mit unserem langjährigen Kooperationspartner Maruho unterzeichnet, in dessen Rahmen wir eine mittlerweile geflossene Einmalzahlung in Höhe von 6 Mio. EUR verzeichnen konnten. Diese Partnerschaft gibt uns die Möglichkeit, mit geringen Kosten sowie geringen Geschäftsrisiken langfristig Erlöse in Märkten zu generieren, die wir mit eigenen Ressourcen absehbar nicht bedienen können. Wir werden uns weiterhin auf die für uns wichtigsten und schon bekannten Kernabsatzmärkte USA und Europa konzentrieren. Dabei werden wir unvermindert weiter daran arbeiten, die Marktposition unserer Produkte Ameluz® und XepiTM zu stärken, um das Marktpotenzial in den bereits genehmigten sowie in neuen Indikationen langfristig erfolgreich ausschöpfen zu können."
Update klinische Entwicklungen
Im Januar 2020 berichtete Biofrontera über 12-monatige Nachbeobachtungs-Ergebnisse der Phase III-Studie zur Behandlung von aktinischen Keratosen an den Extremitäten und am Rumpf bzw. Hals mit einer Rezidivrate der Läsionen nach einem Jahr von 14,1% nach der Ameluz®-Behandlung, verglichen mit 27,4% nach der Placebo-Behandlung. Basierend auf den Ergebnissen der Studie genehmigte die Europäische Kommission im März 2020 die Zulassungserweiterung für Ameluz® zur Behandlung von aktinischer Keratose an Extremitäten, Rumpf und Hals. Gleichzeitig genehmigte die Europäische Kommission die Aufnahme eines zusätzlichen Überlegenheitsanspruches gegenüber europäischen PDT-Wettbewerbern in die Produktinformation, der explizit die geringere Rezidivrate nach Tageslicht-PDT mit Ameluz® im Vergleich zum Konkurrenzmedikament ausweist.
In den USA arbeitet Biofrontera an verschiedenen Initiativen zur Indikationserweiterung von Ameluz® und zu nachhaltigem Wachstum in den kommenden Jahren. Biofrontera rekrutiert weiterhin Patienten für die US-Phase-III-Studie mit Ameluz® zur Behandlung von oberflächlichen Basalzellkarzinomen (BCC). Aufgrund der schleppenden Patientenrekrutierung erwartet das Unternehmen die Bekanntgabe von Studienergebnissen nicht vor 2021. Die Zulassung von Ameluz® für oberflächliche BCC würde die Marktchancen von Ameluz® erheblich erweitern, da sich Ameluz® durch diese Zulassung gegenüber dem konkurrierenden PDT-Medikament deutlich abheben könnte. Zusätzlich hat Biofrontera, wie von der U.S. Food and Drug Administration (FDA) gefordert, eine Pharmakokinetik-Studie begonnen, um die Sicherheit und Wirksamkeit bei der Anwendung von drei Tuben Ameluz® zu untersuchen. Es wird erwartet, dass die Studie in der zweiten Hälfte des Jahres 2020 abgeschlossen sein wird. Im Zusammenhang mit der Anwendung von Ameluz® auf größeren Körperregionen entwickelt Biofrontera eine "BF-RhodoLED® XL"-Lampe und rechnet derzeit damit, trotz der Covid-19-Krise in der zweiten Hälfte des Jahres 2020 einen Zulassungsantrag bei der FDA einreichen zu können.
Im April 2020 haben Biofrontera und die Maruho Co. Ltd, Japan, einen exklusiven Lizenzvertrag zur Vermarktung von Ameluz® in Ostasien und Ozeanien unterzeichnet. Der Vertrag hat eine Laufzeit von 15 Jahren ab Beginn des Vertriebs und beinhaltet neben einer bereits erfolgten Einmalzahlung von 6 Mio. EUR weitere Meilensteinzahlungen sowie Umsatzbeteiligungen von 6% oder höher in allen durch die Vereinbarung erfassten Ländern. Die Einmalzahlung hilft Biofrontera derzeit, die kurzfristig erforderliche Liquidität abzusichern und den Geschäftsbetrieb während der beispiellosen Krise aufrechtzuerhalten.
Finanzlage
Die Zahlungsmittel und Zahlungsmitteläquivalente beliefen sich auf 7,8 Mio. EUR zum 31. März 2020 im Vergleich zu 11,1 Mio. EUR am 31. Dezember 2019.
Der Konzern konnte bislang jederzeit seine Zahlungsverpflichtungen erfüllen. Die Liquiditätsausstattung ist durch die Bereitstellung einer weiteren Tranche des Kredits der European Investment Bank über EUR 5 Mio. im Februar 2019 sowie die Einmalzahlung in Höhe von 6 Mio. EUR im Rahmen des im April 2020 abgeschlossenen Lizenzvertrags mit Maruho Co. Ltd. (Maruho) kurzfristig gesichert. Biofrontera plant jedoch, im weiteren Verlauf des Jahres 2020 zur mittel- und langfristigen Sicherung der Liquidität eine Kapitalerhöhung durchzuführen und hat der am 28. Mai 2020 stattfindenden Hauptversammlung einen entsprechenden Beschlussvorschlag vorgelegt. Obwohl das Management die Möglichkeit der erfolreichen Durchführung dieser Kapitalmaßnahme derzeit sehr positiv sieht, kann dies jedoch nicht garantiert werden. Sollte dies etwa aufgrund eines unerwartet langen Anhaltens der COVID-19-Pandemie oder aus anderen Gründen nicht möglich sein, könnte sich daraus eine Bestandsgefährdung für die Biofrontera-Gruppe ergeben.
Prognose 2020
Die Geschäftsentwicklung ist seit März 2020 direkt von den Auswirkungen der COVID-19-Pandemie betroffen. Chronische Krankheiten wie die aktinische Keratose standen während der Krise nicht im Vordergrund der ärztlichen Tätigkeit. Da derzeit nicht absehbar ist, wie lange und wie stark sich die Pandemie wirtschaftlich auswirken wird, sind auch die spezifischen Folgen für Umsatz und Ergebnis für das Geschäftsjahr 2020 nicht verlässlich abzuschätzen oder genauer zu quantifizieren. Deshalb ist die Prognosefähigkeit der Biofrontera nach wie vor wesentlich beeinträchtigt. Die Gesellschaft kann daher zum gegenwärtigen Zeitpunkt keine über die Aussagen im Geschäftsbericht hinausgehenden Prognosen zum Geschäftsverlauf im Jahr 2020 geben.
Die Biofrontera AG ist ein biopharmazeutisches Unternehmen, das auf die Entwicklung und den Vertrieb dermatologischer Medikamente und medizinischer Kosmetika spezialisiert ist.
Das Leverkusener Unternehmen mit weltweit rund fast 200 Mitarbeitern entwickelt und vertreibt innovative Produkte zur Heilung, zum Schutz und zur Pflege der Haut. Zu den wichtigsten Produkten gehört Ameluz®, ein verschreibungspflichtiges Medikament zur Behandlung von hellem Hautkrebs und dessen Vorstufen. Ameluz® wird seit 2012 in der EU und seit Mai 2016 in den USA vermarktet. Darüber hinaus vertreibt das Unternehmen in den USA das verschreibungspflichtige Medikament XepiTM zur Behandlung von Impetigo. In Europa vertreibt das Unternehmen zudem die Dermokosmetikserie Belixos®, eine Spezialpflege für geschädigte oder erkrankte Haut.
Biofrontera ist das erste deutsche Gründer-geführte pharmazeutische Unternehmen, das eine zentralisierte europäische und eine US-Zulassung für ein selbst entwickeltes Medikament erhalten hat. Die Biofrontera-Gruppe wurde 1997 vom heutigen Vorstandsvorsitzenden Prof. Dr. Hermann Lübbert gegründet und ist an der Frankfurter Börse (Prime Standard) und an der US-amerikanischen NASDAQ gelistet. www.biofrontera.com
Biofrontera AG
Hemmelrather Weg 201
51377 Leverkusen
Telefon: +49 (214) 87632-0
Telefax: +49 (214) 87632-90
http://www.biofrontera.com
Finanzvorstand
Telefon: +49 (214) 87632-0
Fax: +49 (214) 87632-90
E-Mail: t.schaffer@biofrontera.com
![]()